BAB VIII
KESETIMBANGAN KIMIA
A. Keadaan Kesetimbangan
Fakta menunjukkan bahwa banyak reaksi yang dapat berlangsung secara reversibel atau bolak balik.
Misalnya campuran antara Nitrogen, N2 dan hidrogen, dengan perbandingan 1 : 3 pada suhu kamar tidak dapat berlangsung, tetapi bila campuran tersebut dipanaskan pada 200oC dan tekanan 30,4 kPa serta adanya katalisator ternyata N2 dan H2 dapat bereaksi dengan cepat membentuk NH3.
N2(g) ® 3H2(g) + 3NH3(g)
Demikian juga pada suhu kamar NH3 tidak dapat diuraikan N2 dan H2, tetapi NH3 dipanaskan 200oC dan tekanan 30,4 kPa serta adanya katalisator akan teruraikan menjadi N2 dan H2.
2NH3(g) ® N2(g) + 3H2(g)
berdasarkan hasil percobaan baik reaksi antara N2 dan H2 maupun peruraian NH3 pada kondisi tersebut konsentrasi reaktan dan produk menjadi konstan setelah campuran mengandung 67,6% NH3 dan 32,4% terdiri dari N2 dan H2. Kemudian timbul pertanyaan apakah kedua reaksi tersebut berhenti setelah campuran mengandung NH3 sebanyak 67,6%?.
Mengingat bahwa pada suhu dan tekanan tersebut N2 dan H2 dapat bereaksi menjadi NH3 dan sebaliknya NH3 juga dapat terurai menjadi N2 dan H2, fakta tersebut menunjukkan bahwa reaksi antara N2 dan H2 pada kondisi tertentu dapat berlangsung bolak balik. Hal ini dapat diterangkan bahwa pada reaksi antara N2 dan H2 mula-mula berlangsung cepat dan konsentrasi N2 dan H2 makin berkurang, sedang konsentrasi NH3 makin bertambah. Oleh karena itu NH3 yang terbentuk mula-mula akan terurai kembali dengan lambat dan lama kelamaan menjadi cepat hingga pada suatu saat setelah campuran mengandung NH3 sebanyak 67,6% kecepatan terbentuknya NH3 sama dengan kecepatan terbentuknya kembali N2 dan H2 sehingga banyaknya masing-masing komponen menjadi tetap.
Demikian juga pada fakta kedua, kecepatan terurainya NH3 mula-mula cepat tetapi lama kelamaan makin berkurang karena konsentrasi NH3 makin berkurang. Sebaliknya N2 dan H2 yang terbentuk makin banyak, maka N2 dan H2 akan bereaksi kembali membentuk NH3 dengan kecepatan yang makin bertambah. Pada suatu saat kecepatan terurainya NH3 sama dengan kecepatan terbentuknya kembali NH3 sehingga banyaknya masing-masing komponen menjadi tetap.
Jadi reaksi tersebut dapat berlangsung bolak-balik atau reversibel yang pada suatu ketika kecepatan terbentuknya produk sama dengan kecepatan terbentuknya kembali reaktan, sehingga konsentrasi produk dan reaktan kelihatan tetap.
Suatu reaksi kimia dimana kecepatan terbentuknya produk sama dengan kecepatan terbentuknya kembali reaktan dikatakan reaksi tersebut dalam keadaan setimbang.
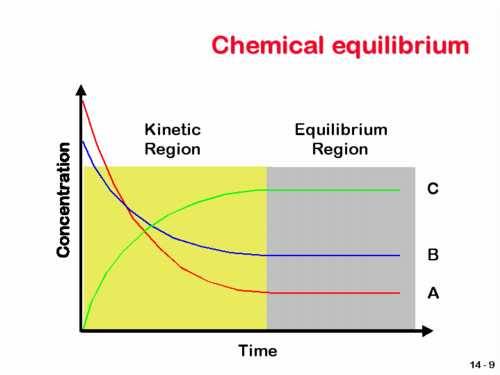
Hubungan antara kecepatan reaksi dan waktu pada sistem kesetimbangan kimia N2(g) + 3H2(g) Û 2NH2(g) dapat digambarkan sebagai berikut:
Gambar .8.1. Hubungan antara kecepatan dan waktu reaksi
3H2(g) + N2(g) Û 2NH3(g)
B. Hukum Kesetimbangan san Tetapan Kesetimbangan
Harga tetapan kesetimbangan suatu reaksi kimia ditentukan dari hasil percobaan. Misalnya tetapan kesetimbangan reaksi:
3H2(g) + N2(g) Û 2NH3(g)
Ditentukan dengan mencapurkan N2 dan H2 dengan berbagai perbandingan pada suhu 500oC. Dari hasil percobaan diketahui bahwa setelah reaksi tersebut mencapai kesetimbangan konsentrasi masing-masing gas seperti tertera pada tabel berikut:
Tabel 1. Hasil reaksi kesetimbangan
N2(g) + 3H2(g) Û 2NH3(g) pada 500oC
Percobaan |
Konsentrasi (mol dm-3) |
|
||
|
(H2) |
(N2) |
(NH3) |
||
|
1 2 3 4 5 |
1,150
0,500 1,35 2,43 1,47 |
0,70
1,00 1,15 1,85 0,750 |
1,23 x 10-2
8,66 x 10-2 4,12 x 10-2 1,27 3,76 x 10-2 |
5,98 x 10-2
6,00 x 10-2 6,00 x 10-2 6,08 x 10-2 5,93 x 10-2 |
Rata-rata |
66,00 x 10-2 | |||
Sumber: Brady J.E dan Humiston, G.R, General Chemistry Principle and Structure, 1986, hal. 513.
Data tersebut menunjukkan bahwa konsentrasi NH3 pangkat dua dibagi dengan hasil kali konsentrasi N2 dan konsentrasi H2 pangkat tiga pada berbagai percobaan pada suhu tetap adalah tetap.
Berdasarkan data tersebut dapat disimpulkan bahwa pada reaksi kesetimbangan yang berlangsung pada suhu tetap hasil kali konsentrasi produk pangkat koefisien reaksi dibagi dengan hasil kali reaktan pangkat koefisien reaksi mempunyai harga yang tetap.
Untuk reaksi secara umum:
aA + bB Û cC + dD
Pada keadaan setimbangan dapat dinyatakan:
Persamaan tersebut disebut hukum kesetimbangan dan karena KC pada suhu yang tetap harganya tetap maka disebut ketetapan kesetimbangan.
Untuk reaksi pada fase gas banyaknya reaktan dan produk dapat dinyatakan dengan tekanan parsial, karena tekanan parsial sebanding dengan konsentrasi molar maka untuk reaksi tersebut dinyatakan:
PCl3(g) + Cl2(g) Û PCl5(g)
- Hubungan KC dan KP
Untuk gas ideal berlaku PV = nRT.
Karena = kosentrasi, maka jika
Konsentrasi = = C, sehingga
P = CRT
Untuk reaksi:
aA + bB Û cC + dD
Apabila A, B, C dan D dianggap gas ideal, maka:
KP = KC x (RT)(c+d) – (a-b)
atau
KP = KC x (RT)D ng
dimana:
ng = jumlah koefisien produk-jumlah koefisien reaktan pada fase gas
Misalnya untuk reaksi:
H2(g) + Cl2(g) Û 2HCl(g)
KP = KC
- Makna tetapan kesetimbangan
Secara kuatitatif tetap kesetimbangan dapat ditentukan dengan percobaan. Salah satu cara yaitu dengan mengukur konsentrasi reaktan dan produk pada suhu tertentu.
Sebaliknya tanpa mengukur besarnya konsentrasi reaktan maupun produk jika harga KC dan KP untuk reaksi kesetimbangan tertentu pada suhu tertentu diketahui, harga tersebut secara kualitatif dapat memberikan informasi apakah reaksi tersebut berlangsung secara sempurna. Misalnya untuk reaksi:
2H2O(g) Û 2H2(g) + O2(g)
Pada suhu 25oC mempunyai harga KC = 1,1.10-81. Harga KC tersebut menunjukkan bahwa pada suhu 25oC H2O(g) yang terurai sangat tak terhingga sedikitnya, sehingga jumlah produk sangat jauh lebih kecil daripada reaktan atau boleh dikatakan pada suhu 25oC H2O(g) tidak mengalami peruraian.
Sedangkan untuk reaksi:
2SO2(g) + O2(g) Û2SO2(g)
Pada suhu 25oC mempunyai harga KC = 7,0.1023. harga KC tersebut menunjukkan bahwa pada suhu 25oC SO2 dapat bereaksi sempurna dengan O2 membentuk SO3.
C. Termodinamika dan kesetimbangan kimia
Secara teoritis reaksi kimia dapat berlangsung ke arah balik, namun gaya penggerak reaksi dapat cenderung untuk menuju ke suatu arah saja karena ke arah balik sangat tak terhingga kecilnya sehingga tidak dapat diukur. Gaya penggerak reaksi kimia disebut perubahan energi bebas yang menyertai reaksi tersebut. Jadi perubahan energi bebas yang menyertai suatu reaksi kimia merupakan ukuran kecenderungan ke arah mana reaksi tersebut akan berlangsung.
Menurut hukum Termodinamika suatu proses akan berjalan secara spontan apabila perubahan energi bebasnya (DG) adalah negatif.
Hubungan antara perubahan antara energi bebas (DGo) dengan posisi kesetimbangan kimia dapat digambarkan sebagai berikut:
Gambar tersebut menunjukkan bahwa pada posisi kesetimbangan energi bebas reaktan sama dengan bebas produk, sehingga perubahan energi bebas (DG) = 0.
Gambar 8.2. Hubungan DGo dengan posisi kesetimbangan
Kemudian hubungan antara DG dengan kesetimbangan dapat dijabarkan sebagai berikut:
DG = DGo + RT ln Q
Dimana Q untuk reaksi fase gas adalah hasil kali tekanan parsial produk pangkat koefisien reaksi dengan hasil kali parsial reaktan pangkat koefisien reaksi, sedang untuk reaksi dalam larutan Q adalah hasil kali konsentrasi produk pangkat koefisien reaksi dengan hasil kali konsentrasi reaktan pangkat koefisien reaksi.
Untuk reaksi secara umum:
aA + bB Û cC + dD
DG =
Pada saat kesetimbangan reaktan dan produk mempunyai energi bebas sama atau DG = 0, sehingga:
0 =
DGo =
Karena pada saat kesetimbangan:
= KP
Maka:
DGo = RT ln KP
Untuk larutan dalam larutan:
DGo = RT ln KC
Harga KP dan KC pada persamaan tersebut disebut tetapan kesetimbangan termodinamika.
Contoh soal:
- Tentukan harga tetapan kesetimbangan termodinamika untuk reaksi:
2NO(g) + O2(g) Û 2NO2(g)
Pada suhu 25oC jika diketahui DGo NO(g) = 86,8 kJ mol-1 dan DGof NO2(g) = 51,9 kJ mol-1
Penyelesaian:
Pada keadaan setimbang
DGo = RT ln KP
DGo = 2DGof NO2(g) – 2DGof NO(g) – 2DGof O2(g)
DGo = 2 mol x 51,9 kJ mol-1 – 2 mol x 86,8 kJ mol-1
DGo = -69,8 kJ
ln KP =
ln KP = 28,2
KP = 1,866 x 1012
Harga KP yang jauh lebih besar daripada 0 tersebut juga menunjukkan bahwa reaksi pada suhu 25oC NO beraksi sempurna dengan O2 membentuk NO2.
- Apabila pada reaksi kesetimbangan
2NO2(g) Û N2O4(g)
DHo = -56,9 kJ dan DSo = -175 JoK-1
Tentukan harga Kp pada suhu 125oC!
Penyelesaian:
Menurut hukum termodinamika pada suhu 25oC
DGo = DHo – TDSo
pada suhu selain 25oC dinyatakan:
DG’ = DH’ – TDS’
Karena harga DH dan DS sedikit sekali terpengaruh oleh suhu, maka dengan asumsi bahwa DH dan DS tidak tergantung pada suhu DH’ = DHo dan DS’ = DSo sehingga:
DGo = DHo – TDSo
DG’ = -56900 J – (398 oK)(-175 JoK-1)
DG’ = 12750 J
ln KP =
ln KP =
KP = 2,12 x 10-1
Harga KP tersebut lebih kecil dari 1 menunjukkan bahwa pada suhu 125oC reaksi tersebut cenderung berlangsung ke arah terbentuknya NO2.
D. Kesetimbangan Heterogen
Reaksi kesetimbangan yang telah dibahas sebelumnya adalah merupakan kesetimbangan homogen karena zat terselibat dalam reaksi tersebut mempunyai fase sama. Suatu sistem kesetimbangan kimia di mana zat-zat yang terlibat dalam reaksi mempunyai fase yang berbeda disebut sistem kesetimbangan heterogen.
Misalnya reaksi dekomposisi NaHCO3(g) merupakan kesetimbangan sebagai berikut:
2NaHCO3(g) Û Na2CO3(s) + CO2(s) + CO2(g) + H2O(g)
Hukum kesetimbangan reaksi tersebut dapat dijabarkan sebagai berikut:
Karena konsentrasi Na2 CO3(s) dan NaHCO3(s) tetap maka:
Atau
(CO2(g))(H2O(g)) x (RT)+2
Jadi pada kesetimbangan heterogen harga tetapan kesetimbangan tidak mengekspresikan zat dalam fase padat.
Apabila kesetimbangan dinyatakan dengan KP
KP = PCO2(g) x PH2O(g)
Atau
KP = (CO2(g)) (H2O(g)) x (RT)+2
Contoh soal:
Tentukan harga KC dan KP untuk kesetimbangan
H2O(g) Û H2O(g)
Pada suhu 25oC, jika tekanan uap air di udara pada suhu 25oC = 3,17 kPa.
Penyelesaian:
KP = P H2O(g) = 3,17 kPa
KC = KP x (RT)-ng
KC = 3,17 kPa x (8,314 dm3 kPa mol-1 oK-1) (298oK-1)
KC = 1,28 x 10-3 mol dm-3
Contoh kesetimbangan heterogen yang lain:
CaCO3(s) Û CaO(s) + CO2(g)
C(s) + O2(g) Û 2CO(g)
CuSO4.5H2O(s) Û CuSO4.3H2O(s) + 2H2O(g)
Pada suhu 25oC dekomposisi CuSO4.5H2O mengalami kesetimbangan pada tekanan 7,8 mmHg. Karena tekanan uap air di udara sekitar 8 – 12 mmHg, maka jika hidrat tersebut dibiarkan di udara tidak akan kehilangan air, tetapi sebaliknya CuSO4.3H2O dibiarkan di udara akan mengikat uap air di udara sehingga mencapai kesetimbangan.
E. Faktor-Faktor Yang Mempengaruhi Kesetimbangan Kimia
Menurut prinsip Chatelier apabila pada sistem kesetimbangan dinamis ada daktor yang mempengaruhi maka untuk mengurangi pengaruh tersebut, sistem kesetimbangan akan berubah hingga mencapai kesetimbangan kembali.
- Pengaruh perubahan konsentrasi reaktan atau produk
Misalnya pada sistem kesetimbangan:
H2(g) + I2(g) Û2HI(g)
Setiap perubahan konsentrasi reaktan maupun konsentrasi reaktan terhadap kesetimbangan tersebut akan menyebabkan sistem menjadi tidak setimbang, sehingga akan terjadi pergeseran kesetimbangan hingga sistem menjadi setimbang kembali.
Apabila ke dalam sistem kesetimbangan tersebut ditambahkan H2 maka I2 dalam sistem akan bereaksi dengan H2 hingga HI menjadi lebih banyak. Setelah terjadi kesetimbangan kembali konsentrasi HO menjadi lebih besar dari semula, oleh karena itu dapat dikatakan bahwa penambahan konsentrasi reaktan pada sistem kesetimbangan tersebut menyebabkan kesetimbangan bergeser ke arah kanan atau ke arah produk.
Sebaliknya apabila ke dalam sistem tersebut ditambahkan HI maka kesetimbangan akan bergeser ke arah kiri atau ke arah reaktan.
Pengaruh perubahan konsentrasi terhadap sistem kesetimbangan kimia ditinjau dari hukum kesetimbangan dapat diterangkan sebagai berikut:
Misalnya untuk sistem kesetimbangan:
2SO2(g) + O2(g) Û2SO3(g)
Apabila ke dalam sistem tersebut ditambah SO2 maka (SO2(g)) menjadi lebih besar, sehingga apabila setelah ditambah SO2:
Maka :
KC’ < KC
Karena pada suhu tetap harga KC juga tetap maka agar KC’ = KC konsentrasi SO2 harus diperkecil atau kesetimbangan digeser ke arah pembentukan SO3.
Proses demineralisasi dan remineralisasi Ca5(PO4)3OH(s) yang terdapat pada email gigi merupakan salah satu contoh penggunaan hukum de Chatelier.
Pada gigi yang sehar terdapat kesetimbangan zat seperti di atas, tetapi apabila gigi mengabsorbsi dan gula mengalami fermentasi, maka kesetimbangan akan terganggu karena H+ akan beraksi dengan OH– membentuk H2O dan ion PO43- akan menyebabkan HPO42. Berkurangnya ion OH– dan ion PO43- akan menyebabkan Ca5(PO4)3OH– yang larut lebih banyak, sehingga gigi menjadi rusak. Fluorida dapat mencegah kerusakan gigi karena dapat menggantikan OH– dalam Ca5(PO4)3OH terbentuknya Ca5(PO4)3F, sangat resisten terhadap asam.
- Pengaruh perubahan suhu
Telah dijelaskan bahwa harga tetapan kesetimbangan adalah tetap pada suhu tetap, sehingga perubahan suhu dapat mempengaruhi sistem kesetimbangan.
Berdasarkan prinsip de Chatelier apabila dalam sistem kesetimbangan suhu dinaikkan maka kesetimbangan akan bergeser ke arah bagian yang menyerap panas.
Misalnya apda isstem ksetimbangan:
N2(g) + 2O2(g) Û 2NO(g) – 10 ,397 kJ
Apabila suhu dinaikkan kesetimbangan akan bergeser ke arah pembentukan NO.
Secara umum apabila pada sistem kesetimbangan endoterms suhu dinaikkan kesetimbangan akan bergeser ke arah terbentuknya produk, sebaliknya bila pada kesetimbangan eksoterm suhu dinaikkan kesetimbangan akan bergeser ke arah reaktan.
Hubungan antara tetapan kesetimbangan dengan suhu dapat dinyatakan dengan persamaan:
Untuk reaksi yang berlangsung eksoterm misalnya:
N2(g) + 3H2(g) Û 2NH3(g) DHo = -92 kJ
2SO2(g) + O2(g) Û 2SO3(g) DHo = -198 kJ
Kenaikkan suhu akan menyebabkan kesetimbangan bergeser ke arah kiri. Atau harga K akan turun jika suhu naik sedang untuk reaksi endotermis harga K akan naik jika suhu dinaikkan.
Contoh soal:
Perubahan entalpi standar, DHo pada reaksi berikut:
2NO2(g) + O2(g) Û 2NO2(g)
Adalah –113 kJmol-1 dan tetapan kesetimbangan pada suhu 25oC = 1,6.1012. tentukan harga KP pada suhu 125oC.
Penyelesaian:
KP = 1,9254 x 10-8
- Pengaruh perubahan tekanan dan volume
Pada suhu tetap perubahan volume sistem akan menyebabkan perubahan tekanan. Menurut hukum Boyle kenaikan tekanan eksternal sistem akan menyebabkan volume sistem berkurang.
Karena tekanan gas disebabkan oleh tumbukan molekul-molekul gas terhadap dinding vesel, maka bila jumlah molekul lebih banyak tekanan akan lebih besar.
Sehingga pada kesetimbangan:
N2(g) + 3H2(g) Û 2NH3(g)
Apabila tekanan gas diperbesar kesetimbangan akan bergeser ke arah kanan (ke arah yang jumlah molekulnya leih kecil). Atau bila para kesetimbangan kimia volume dikecilkan kesetimbangan akan bergeser ke arah yang jumlah molekulnya lebih kecil. Secara matematika dapat dibuktikan akan sistem kesetimbangan seperti berikuti:
N2(g) + I2(g) Û 2HI(g)
Baik perubahan tekanan maupun perubahan volume tidak akan merubah letak kesetimbangan.
- Pengaruh penambahan katalisator
Pada bab sebelumnya dijelaskan bahwa pengaruh katalisator pada reaksi kimia adalah menurunkan energi pengaktivan atau mengurangi rintangan energi yang harus dilampaui agar reaksi berlangsung lebih cepat.
Pada sistem kesetimbangan adanya penambahan katalisator tidak mempengaruhi posisi kesetimbangan, melainkan hanya mempercepat tercapainya kesetimbangan.
- F. Beberapa Contoh Perhitungan
- Pada suhu 25oC suatu campuran kesetimbangan:
N2(g) O4 Û 2NO2(g)
Tentukan harga: KP, KC dan DGo 298.
Bila pada saat kesetimbangan tekanan total = 85,5 kPa dan tekanan parsial N2O4 = 57,0 kPa.
Penyelesaian:
- Tekanan parsial NO2 = PNO2 = Ptotal – PN2O4
= 14,25 kPa
- KC = KP x (RT)–Dng = KP x (RT)-1
KC = 5,75 x 10-3 mol dm-3
- Pada saat kesetimbangan DG = 0, sehingga:
DGo = -RT ln KP
DGo = -8,314 k Pa dm3 mol-1K-1 x (298oK) ln 14,25
DGo = -8,314 k Pa dm3 mol-1 x 298 ln 14,25
DGo = -2477,572 k Pa dm3 mol-1 x ln 14,25
DGo = -6582,306 k Pa dm3 mol-1
DGo = -6,582 kJ
- Suatu sistem kesetimbangan kimia
H2(g) + CO2(g) Û CO(g) + H2O(g)
Pada suhu 750oC mempunyai harga KC = 0,771. Bila 1 mol H2 dan 1 mol CO2 dimasukkan dalam vesel yang volumenya 5,0 dm3 kemudian dibiarkan beraksi, tentukan konsentrasi masing-masing komponen pada keadaan setimbang.
Penyelesaian:
Misalnya perubahan konsentrasi H2 = x M
|
|
Konsentrasi Mula-mula |
Perubahan Konsentrasi |
Konsentrasi Kesetimbangan |
|
(H2(g)) |
0,2 M |
x M |
(0,2 – x) M |
|
(CO2(g)) |
0,2 M |
x M |
(0,2 – x) M |
|
(CO(g)) |
0 |
x M |
x M |
|
(H2O(g)) |
0 |
x M |
x M |
=
KC = 0,771
x -0,87807 x + 0,175614
x = 0,0935
Jadi pada saat kesetimbangan
(CO(g)) = 9,35.10-2 M
(H2O(g)) = 9,35.10-2 M
(H2(g)) = 1,065.10-1 M
(CO2(g)) = 1,065.10-1 M
- Dalam ruang yang volumenya 1 dm3 pada suhu 25oC terdapat kesetimbangan:
H2(g) + I2(g) Û 2HI(g)
Dengan konsentrasi pada kesetimbanga:
(H2) = 0,001 M
(I2) = 0,025 M
(HI) = 0,022 M
Tentukan konsentrasi H2, I2 dan HI yang baru bila ke dalam sistem tersebut ditambahkan 0,0005 mol I2!
Penyelesaian:
| Konsentrasi
Mula-mula |
Perubahan
Konsentrasi |
Konsentrasi
Kesetimbangan |
|
| (H2(g)) | 0,001 M | x M | (0,001 – x) M |
| (I2(g)) | (0,025+0,0065)M | x M | (0,0255 – x) M |
| (HI(g)) | 0,022 M | x M | (0,022 + 2 x) M |
Setelah kesetimbangan yang baru KC harus = 19,36.
Sehingga:
0,000484 + 0,088 + 4x2 = 19,36 (x2 – 0,0265x + 0,0000255)
0,000484 + 0,088 x + 4x2 = 19,36 x2 – 0,51304 + 0,00049368
15,36 x2 – 0,60104 x + 0,00000968 = 0
x2 – 0,0391 x + 0,00000063 = 0
x1 = 0,039085 (tidak mungkin)
x2 = 0,000015
Setelah tercapai kesetimbangan yang baru:
(H2(g)) = (0,001 – 0,000015) = 0,000985 M
(I2(g)) = (0,0255 – 0,000015) = 0,025485 M
(HI(g)) = (0,022 – 0,000030) = 0,02203 M
DAFTAR PUSTAKA
Brady, J.E Dan G.E. Humiston, General Chemistry Priciples And Structure. John Wiley & Sons, New York, 1986.
Hiskia Achmad. Wujud Zat Cair dan Kesetimbangan. ITB, Bandung. 1983.
____________, Stokiometri Energitika Kimia. ITB, Bandung. 1983.
Keenan, Kleinfelter. University Chemistry. Addison Wesley Publishing, Inc, Amsterdam.
Mahan, B.H. University Chemistry. Addison Wesley Publishing. Company, Amsterdam, 1976.
Narsito, dkk. Kimia Dasar. FPMIPA-UGM, Yogyakarta. 1986.
Partington. J.J, MBE Dsc Em Prof. A Text Book Of In Organic Chemistry. Mac Millan And Co, Limt, London, 1953.
Pudjaatmaka. A.H. Kimia Untuk Universitas. Terjemahan, Penerbit Erlangga, Jakarta. 1989.
Sandi Setiawan. Theory Of Everything. Andi Offset, Yogyakarta. 1991.
Satya Prakash Et All. Advanched In Organic Chemistry. S Chand & Company, Ltd, New Delhi, 1980.